1 早期诊断的重要性
早期诊断的目的是为了及时发现感染猪,并及时扑灭传染源。传染病的发生必需具备3个环节,即传染源、传播途径、易感动物,控制任一环节即能控制传染病的发生。对于ASF来说传播途径多,具体到某个猪场,到底是如何传入的,仍然只是猜测,没有一个场有明确的证据,因此为了切断所有可能的传播途径,养殖场付出了巨大的人力、物力、财力代价;由于没有疫苗可用,因此从保护易感动物角度来说也不具有可操作性。故此,消灭传染源成了当前防控ASF的主要措施之一,这就需要按照国家有关法律法规早发现、早诊断、早处置。
2 早期诊断的原理
为什么要做早期诊断呢?因为猪感染早期不排毒或排毒少(表1),配合好无害化处理、消毒等措施,不易造成扩大传播。发病猪后期血液中含有大量病毒,病毒滴度可以达108HAD50/mL,而1-10 HAD50的病毒就可感染1头猪,所以每毫升血液理论上可以感染1000万头以上的猪。如果用100吨水来冲冼1mL这样的血液,那么这100吨水中的1mL水仍可感染一头猪,因此运猪车辆的消毒现在弄得比较复杂也是这个道理。所以早期诊断就是要在猪排毒之前发现感染猪,及时扑灭传染源。如果猪舍有病猪存在,甚至在猪场剖检病猪,其病毒污染量将是个天量,疫情扩散压力极大。同时也表明对病猪进行治疗也是非常不合适的,可能救活了一头猪,但感染了一群猪。
当ASF病毒进入养殖场,并感染猪后,首先在感染局部如扁桃体定位增殖,这时并不具有传染性;
表1 猪感染ASF病毒后时间与临床表现、散毒、排毒量关系
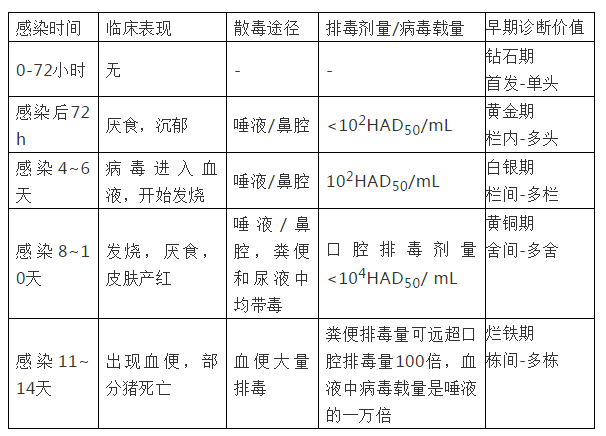
当病毒繁殖到一定量后,侵入血液并到达肺等部位大量增殖,这时猪只可通过排泄器官排毒,传染性逐渐增强。Claire Guinat等研究发现,同群猪只之间自然接触感染猪的潜伏期7-10天,平均9.9天,比人工肌注感染猪的潜伏期长3-6天(平均4.4天)。因此,有足够的时间来检测发现潜伏阶段的猪,这就为早诊断提供了理论基础。步志高团队研究了中国流行毒株在猪只间自然接触感染情况下,第6天口腔拭子可检出,第9天血液中可检出阳性,因此有3天的窗口期供早诊断。从病原检出部位来看,zui早可检出的是扁桃体,然后是口鼻拭子,其次是肛门拭子,zui后是血液。病毒从扁桃体进入血液,猪就开始具有了传染性。因此zui理想的检测样本是扁桃体,其次是口鼻拭子,但考虑到采样的方便性,临床用得zui多的是口鼻拭子或唾液。
3 唾液样本的采集
3.1 唾液的成分
唾液中含有各种复杂的成分,主要有分泌性抗体、各种有益或有害微生物、酶、激素、药物等。很多成分会影响到PCR的正常反应。
3.2 唾液样本的优缺点与改进措施
优点是与厌食同步,早于血液;无应激,易于大栏采集。适用于阴性猪场以七天为节律的监测,引种后的猪群连续14天的监测。缺点是病毒载量较低,样本易被核酸酶降解;采样需避开进食,阳性场可加速传播。改进措施是使用唾液保存液,用冰盒冷冻样本,猪场配备检测仪,迅速处理检测样本。
3.3 唾液采集的风险因素
病毒载量低,对检测方法的灵敏度要求较高;唾液中含有DNA酶和蛋白酶,可降解核酸;进食前后蛋白酶和DNA 酶的含量显著增加;不及时冷冻或运输中解冻,核酸均可被降解;在阳性场大群采集唾液时容易造成交叉感染,唾液棉绳不适用于发病场监测。相对而言,鼻腔粘液受到的干扰因素较小,采样时可同时采口腔拭子和鼻拭子,分开保存,使用时合并。
3.4 唾液大群采集程序
(1)固定取样绳:在栏舍内悬着一个位置固定取样绳,要保证栏内所有猪均可接触到取样绳。固定位置应该干净,远离饮水和进食区。取样绳低端应与猪站立时嘴的高度相平。如果同栏内分配多个取样绳,它们的位置尽可能的分开。宜在进食前两小时或进食后两个小时后进行采样。
(2)取样绳放置时间为30分钟。如果发现采样对象对取样绳不够活跃,可延长至1小时。
(3)小心取下取样绳,注意不要接触到地面。将取样绳内的唾液挤至无菌自封袋内。
(4)将上述自封袋剪开一个小口,将里面的唾液转移至准备好的无菌试管内。每个样品至少需要2ml。
(5)收集后,如果发现试管内有明显杂质,如饲料等,则需用离心机对样品进行纯化。离心机转速为2000转/分钟,离心1分钟。
(6)所取得的样本迅速放入冰盒中,或加入核酸保护液储存。
(7)在试管上标明取样栏舍、取样猪场、取样日期。
(8)采样时操作尽量快,需速冻,操作时间不能超过2h。
(9)所取得的样本迅速放入冰盒中,或加入核酸保护液储存。
(10)注意事项:采样时需带双层手套,每采一栏需更换外层PE手套;唾液运输过程中需保持冷冻状态;实验室检测时也要注意化冻后速检。
3.5 鼻腔或唾液拭子的采集方法
(1)操作者需佩戴乳胶手套后再佩戴一次性PE手套。
(2)选用长度大于10cm的长棉签,建议三根棉签同时采集鼻腔液或口腔液。
(3)棉签深入鼻腔或口腔至少8cm以上,搅动三圈,当棉签完全润湿后取出。
(4)将采集后的棉签放入自封袋中,准确标号(采样时间,样本原始编号,样品类型)。
(5)应做好原始记录;也可将棉签折断,将棉头部分放入EP管中。
(6)采集下一头猪时需更换PE手套。
(7)将采集后的样本放入冰盒中,样本需冷冻保存和运输。
3.6 血液和脏器散毒的风险极高,不适宜早期诊断
所有发病死亡猪体内均可检测到高水平ASFV载量,发病后期血液病毒滴度可达108 HAD50/ml以上,病死猪脾脏、淋巴结、肝、肾等器官组织病毒滴度介于105-108 HAD50/ml。依据测定Pig/HLJ/18毒株对猪半数致死剂量(PLD50)结果,病死猪每毫升血液所含PLD50病毒量达100万以上,每克组织所含PLD50病毒量达10万以上。 非洲猪瘟 感染猪凝血性差,静脉采血容易血流不止,散播风险极大。

4 早期检测方法
ASF病毒检测方法有经细胞吸附试验、双抗体夹心ELISA、胶体金试纸、荧光定量PCR、普通PCR、LAMP方法、热对流PCR等方法。目前zui适宜和应用zui广的荧光定量PCR方法。
4.1 荧光定量PCR方法的优缺点
荧光定量PCR是OIE推荐的ASF的检测方法。机器判读, 误差概率低,敏感性是普通PCR的100倍; 特异性高, 极少因方法的原因,出现假阳性; 含量可做为决策的依据,可在不同时间和不同空间上进行数据间的比较;操作环境要求低,可在实验室、野外进行核酸检测。缺点是需要仪器设备。
4.2 如何避免假阳性
荧光定量PCR在实际应用过程中出现假阳性的因素主要有3个方面。一是采样不当,原因是采样过程中导致的交叉污染,防范措施是加强采样规范。二是操作不当,原因是操作过程中样品间交叉污染,防范措施是多练习总结,熟能生巧。三是PCR产物污染,原因是上一次PCR产物形成的污染,防范措施是PCR管绝对不能开盖,甚至电泳,还有添加UNG酶。
4.3 如何避免假阴性
假阴性出现的原因主要表现在4个方面。一是操作不当,原因是核酸提取或试剂应用不到位,设置阴阳对照,可发现问题。二是试剂失效,主要是保存不当造成,设置阴阳对照,可发现问题。三是设备因素,主要是设备孔间差,收集不到信号呈现假阴性结果,很难被发现,可通过换不同设备对照检测发现问题。四是样本因素,样本中含有导致PCR效率降低或完全被抑制的成分呈现假阴性结果,很难被发现,可结合猪临床表现、流行病学分析及时发现问题。
5 后记
ASF的早期诊断是一个复杂的过程,综合了多种学科的技术,因此对管理、生产、技术人员的要求大大提高。显然这个技术不适用于中小规模猪场,而我国中小规模猪场数量庞大,它们的成败决定了ASF在我是是否能控制住的问题。所以防控ASF的任务仍然任重道远。


